リファブチン
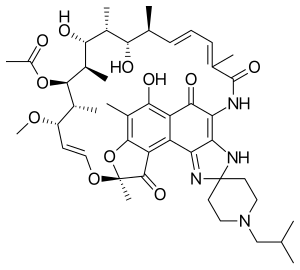 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Mycobutin[1] |
| Drugs.com | monograph |
| MedlinePlus | a693009 |
| 胎児危険度分類 | |
| 法的規制 |
|
| 投与経路 | by mouth (capsules) |
| 薬物動態データ | |
| 生物学的利用能 | 85% |
| 血漿タンパク結合 | 85% |
| 代謝 | liver |
| 半減期 | 28 to 62 hours (mean) |
| 排泄 | kidney and fecal |
| 識別 | |
| CAS番号 | 72559-06-9  |
| ATCコード | J04AB04 (WHO) |
| PubChem | CID: 6323490 |
| DrugBank | DB00615  |
| ChemSpider | 10482168  |
| UNII | 1W306TDA6S  |
| KEGG | D00424  |
| ChEBI | CHEBI:45367  |
| ChEMBL | CHEMBL444633  |
| 化学的データ | |
| 化学式 | C46H62N4O11 |
| 分子量 | 847.005 g/mol |
| |
| |
| テンプレートを表示 | |
リファブチン(Rifabutin, Rfb)は結核の治療に用いられる 抗生物質であり、マイコバクテリウム・アビウム・コンプレックス(Mycobacterium avium complex、MAC)症の予防と治療にも用いられる[1]。一般的にリファンピシンが許容できない抗レトロウィルス薬を服用しているHIV/エイズ患者に用いられる[1]。活性結核にはその他の抗酸菌症治療薬と共に使用される[1]。多剤耐性結核に曝露した場合の潜在的結核に対しては単剤で使用される[1]。
主な副作用は腹痛、吐き気、発疹、頭痛、好中球減少症である[1]。その他の副作用は筋肉痛やぶどう膜炎である[1]。妊娠中の患者への悪影響は報告されていないものの調査もされていない[1]。リファブチンはリファマイシン(Rifamycin)に属する医薬品である[1]。作用機序は不明確である[1]。
リファブチンは1992年にアメリカで医薬品として承認された[1]。日本では2008年7月に承認された。世界保健機関の必須医薬品リストに掲載されている最も効果的で安全な医療制度に必要とされる医薬品である[2]。開発途上国での卸値は1か月分で約$30米ドルである[3]。米国での1か月の治療のかかる薬の値段は$200米ドル以上である[4]。
効能・効果
- 結核症[5]
- マイコバクテリウム・アビウムコンプレックス(MAC)症を含む
- 非結核性抗酸菌(NTM)症
- HIV感染患者における播種性MAC症の発症抑制
リファブチンは2008年時点では、結核の第一選択薬として推奨されている[6]。
リファブチンは、後期AIDS患者によく見られる細菌感染症であるマイコバクテリウム・アビウム・コンプレックス症の治療にも使用される。リファブチンはリファンピシンに比べて薬物相互作用が少ないことから、HAARTを実施しているHIV/AIDS患者の結核治療には、通常、リファブチンが投与される。
HIV関連の結核患者におけるリファブチンの忍容性は良好であるが、CD4細胞数が低い場合には、後天的リファマイシン耐性による治療失敗や再発のリスクが高いことが新しい知見で示唆された。結核とHIV/AIDSを併発している患者は、先ず結核の治療を受ける可能性が高いため、結核治療開始時にCD4が抑制されている場合、医師や患者はリファマイシン耐性の可能性に注意する必要がある。
リファブチンは、抗MAP療法の一環として、クローン病の治療を目的とした試験でも検討されている。MAP感染が確認されていない患者にリファブチンを治療量以下で併用投与した第3相試験では、短期的に有意な効果が得られた[7][8]。
また、Chlamydophila pneumoniae(Cpn)感染症の治療にも有用であることが判明している。
禁忌
リファブチンは主な代謝酵素である肝シトクロムP450(CYP3A4など)を強く誘導するので、同酵素で代謝される医薬品や同酵素を阻害する医薬品の一部は、併用禁忌薬とされている[5]。
- ボリコナゾール
- グラゾプレビル
- エルバスビル
- ダクラタスビル
- アスナプレビル
- チカグレロル
- アルテメテル・ルメファントリン
- リルピビリン・テノホビル アラフェナミド・エムトリシタビン
これら以外にも、併用注意とされている医薬品が多数存在する[5]。
副作用
重大な副作用は[5]、
- 白血球減少症(6.06%)、貧血(1.74%)、血小板減少症(1.59%)、汎血球減少症(0.16%)
- 肝機能異常(1.93%)、黄疸(0.72%)、肝炎
- ショック(0.09%)
- 心停止(0.06%)、心室細動(0.03%)、不整脈(0.03%)
- 脳出血(0.03%)
- 溶血性貧血(0.03%)
- 消化管出血(吐血、メレナ、胃腸出血)(0.12%)
- 偽膜性大腸炎(1.39%)
- 深部静脈血栓症(0.09%)、血栓性血小板減少性紫斑病(0.03%)
- 腎機能障害(0.53%)
- 筋痙縮(0.09%)
- 痙攣(0.37%)
- 精神病性障害(0.09%)
- 歩行障害(0.09%)
- ぶどう膜炎(2.72%)
とされている。
作用機序
リファブチンの細菌に対する効果は、DNA依存性RNAポリメラーゼ阻害剤リファマイシンSと同様である。例えば、耐性の高いマイコバクテリア、グラム陽性菌(一部のグラム陰性菌にも有効)だけでなく、結核菌、らい菌、M. avium-intracellulare(MAI)にも有効である。
歴史
リファブチンはイタリアの製薬会社Achifar社により1975年に発見された。この会社の子会社であるアドリア・ラボラトリーズは、1990年代初頭にリファブチンをでFDA(米国食品医薬品局)に申請し、1992年12月にFDAの承認を得た。
日本ではエイズ治療研究を目的に個人輸入されていたが、2005年10月の未承認薬使用問題検討委員会で承認申請が要請され、2006年6月には厚生労働省やPMDAからも承認申請が要請された結果、海外臨床データのみに基づいて2007年6月に業者より承認申請され、2008年7月に承認された[9]:1。
外部リンク
- “Rifabutin”. Drug Information Portal. U.S. National Library of Medicine. 2021年6月4日閲覧。
出典
- ^ a b c d e f g h i j k “Rifabutin”. The American Society of Health-System Pharmacists. 2016年12月20日時点のオリジナルよりアーカイブ。2016年12月8日閲覧。
- ^ “WHO Model List of Essential Medicines (19th List)”. World Health Organization (2015年4月). 2016年12月13日時点のオリジナルよりアーカイブ。2016年12月8日閲覧。
- ^ “Rifabutin”. International Drug Price Indicator Guide. 2016年12月8日閲覧。
- ^ Hamilton, Richart (2015). Tarascon Pocket Pharmacopoeia 2015 Deluxe Lab-Coat Edition. Jones & Bartlett Learning. p. 50. ISBN 9781284057560
- ^ a b c d “ミコブティンカプセル150mg 添付文書”. www.info.pmda.go.jp. PMDA. 2021年6月5日閲覧。
- ^ Guidelines for the programmatic management of drug-resistant tuberculosis: emergency update 2008 (WHO/HTM/TB/2008.402). Geneva, Switzerland: World Health Organization. (2008). p. ix. ISBN 978-92-4-154758-1. オリジナルの2008-10-18時点におけるアーカイブ。. https://web.archive.org/web/20081018020405/http://www.who.int/tb/publications/2008/programmatic_guidelines_for_mdrtb/en/index.html
- ^ Selby, Warwick; Pavli, Paul; Crotty, Brendan; Florin, Tim; Radford-Smith, Graham; Gibson, Peter; Mitchell, Brent; Connell, William et al. (June 2007). “Two-Year Combination Antibiotic Therapy With Clarithromycin, Rifabutin, and Clofazimine for Crohn's Disease”. Gastroenterology 132 (7): 2313–2319. doi:10.1053/j.gastro.2007.03.031. PMID 17570206.
- ^ Kuenstner, J. Todd (November 2007). “The Australian Antibiotic Trial in Crohn's Disease: Alternative Conclusions From the Same Study”. Gastroenterology 133 (5): 1742–1743. doi:10.1053/j.gastro.2007.09.012. PMID 17983824.
- ^ “ミコブティンカプセル150mg インタビューフォーム”. PMDA. 2021年6月5日閲覧。







